Tabla periódica de los elementos
La tabla periódica es un esquema que incluye a los elementos químicos dispuestos por orden de número atómico creciente y en una forma que refleja la estructura de los elementos.
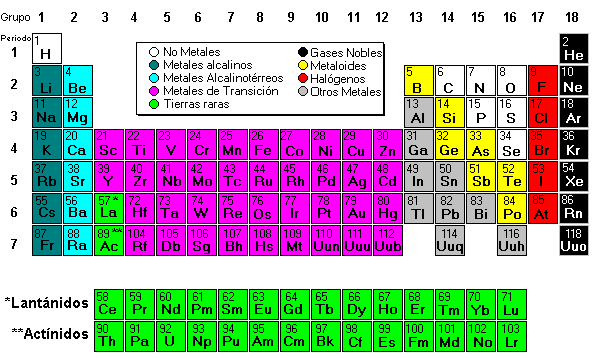
Los elementos están ordenados en siete hileras horizontales, llamadas periodos, y en 18 columnas verticales, llamadas grupos.
El primer periodo (la primera hilera), que contiene dos elementos, el hidrógeno y el helio, y los dos periodos siguientes, cada uno con ocho elementos, se llaman periodos cortos.
Los periodos restantes, llamados periodos largos, contienen 18 elementos en el caso de los periodos 4 y 5, o 32 elementos en el del periodo 6.
El periodo largo 7 incluye el grupo de los actínidos, que ha sido completado sintetizando núcleos radiactivos más allá del elemento 92, el uranio.
Los grupos o columnas verticales de la tabla periódica se clasifican tradicionalmente de izquierda a derecha utilizando números romanos seguidos de las letras 'A' o 'B', en donde la 'B' se refiere a los elementos de transición.
Todos los elementos de un grupo presentan una gran semejanza y, por lo general, difieren de los elementos de los demás grupos. Por ejemplo, los elementos del grupo I A, a excepción del hidrógeno, son metales con valencia química +1; mientras que los del grupo VIIA, exceptuando el astato, son no metales, que normalmente forman compuestos con valencia -1.
Estructura y organización de la tabla
periódica

La tabla periódica actual es un sistema donde se clasifican los elementos conocidos hasta la fecha. Se colocan de izquierda a derecha y de arriba a abajo en orden creciente de sus números atómicos. Los elementos están ordenados en siete hileras horizontales llamadas periodos, y en 18 columnas verticales llamadas grupos o familias.
Hacia abajo y a la izquierda aumenta el radio atómico y el radio iónico.
Hacia arriba y a la derecha aumenta la energía de ionización, la afinidad electrónica y la electronegativo.
Grupos
A las columnas verticales de la tabla periódica se les conoce como grupos o familias. Hay 18 grupos en la tabla periódica estándar, de los cuales diez son grupos cortos y los ocho restantes largos, que muchos de estos grupos correspondan a conocidas familias de elementos químicos: la tabla periódica se ideó para ordenar estas familias de una forma coherente y fácil de ver.
Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, entendido como el número de electrones en la última capa, y por ello, tienen propiedades similares entre sí.
La explicación moderna del ordenamiento en la tabla periódica es que los elementos de un grupo poseen configuraciones electrónicas similares y la misma valencia atómica, o número de electrones en la última capa. Dado que las propiedades químicas dependen profundamente de las interacciones de los electrones que están ubicados en los niveles más externos, los elementos de un mismo grupo tienen propiedades químicas similares.
Por ejemplo, los elementos en el grupo 1 tienen una configuración electrónica ns1 y una valencia de 1 (un electrón externo) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son excepcionalmente no reactivos y son también llamados gases inertes.
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988 y entre paréntesis según el sistema estadounidense,8 los grupos de la tabla periódica son:
- Grupo 13 (III A): los térreos.
- Grupo 14 (IV A): loscarbonoideos.
- Grupo 15 (V A): losnitrogenoideos .
- Grupo 16 (VI A): los calcógenos oanfígenos.
- Grupo 17 (VII A): los halógenos.
- Grupo 18 (VIII A): los gases nobles.
¿ Cuando se descubrieron los elementos ?
Como podrás comprobar, la mayoría de los elementos no se descubrieron hasta hace unos 300 años.
Antes de 1700
1700-1799
1800-1849
1850-
Antimonio
NitrógenoBerilio
Aluminio
Actinio
|
|
Antes de 1700
|
1700-1799
|
1800-1849
|
1850-
|
|
Antimonio
Plata
Arsénico
CarbonoCobre
Estaño
HierroMercurio
Oro
FósforoPlomo
Azufre
|
NitrógenoBerilio
Bismuto
Cloro
Cromo
CobaltoFlúor HidrógenoManganeso
Molibdeno
Níquel
OxígenoPlatino
Estroncio
Telurio
Titanio
Tungsteno
Uranio
Itrio
Cinc
Circonio
|
Aluminio
Bario
Boro
Bromo
Cadmio
Calcio
Cerio
Erbio
Yodo
Lantano
Iridio
Litio
Magnesio
Niobio
Osmio
Paladio
PotasioRubidio
Selenio
SilicioSodioTantalio
Torio
Vanadio
|
Actinio
Argón
Cesio
Disprosio
Gadolinio
Galio
Germanio
Helio
Holmio
Indio
Criptón
Neodimio
Neón
Polonio
Praseodimio
Radio
Rodio
Rutenio
Samario
Escandio
Talio
Tulio
Xenón
Iterbio
|
Descubrimiento de los elementos
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII, cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino–térreos, sobre todo gracias a los trabajos deHumphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII, cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino–térreos, sobre todo gracias a los trabajos deHumphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
Los pesos atómicos
A principios del siglo XIX, John Dalton (1766–1844) desarrolló una concepción nueva del atomismo, a la que llegó gracias a sus estudios meteorológicos y de los gases de la atmósfera. Su principal aportación consistió en la formulación de un "atomismo químico" que permitía integrar la nueva definición de elemento realizada por Antoine Lavoisier(1743–1794) y las leyes ponderales de la química (proporciones definidas, proporciones múltiples, proporciones recíprocas).
Dalton empleó los conocimientos sobre proporciones en las que reaccionaban las sustancias de su época y realizó algunas suposiciones sobre el modo como se combinaban losátomos de las mismas. Estableció como unidad de referencia la masa de un átomo de hidrógeno (aunque se sugirieron otros en esos años) y refirió el resto de los valores a esta unidad, por lo que pudo construir un sistema de masas atómicas relativas. Por ejemplo, en el caso del oxígeno, Dalton partió de la suposición de que el agua era un consuetudinario, formado por un átomo de hidrógeno y otro de oxígeno. No tenía ningún modo de comprobar este punto, por lo que tuvo que aceptar esta posibilidad como una hipótesis a priori.
Dalton sabía que una parte de hidrógeno se combinaba con siete partes (ocho, afirmaríamos en la actualidad) de oxígeno para producir agua. Por lo tanto, si la combinación se producía átomo a átomo, es decir, un átomo de hidrógeno se combinaba con un átomo de oxígeno, la relación entre las masas de estos átomos debía ser 1:7 (o 1:8 se calcularía en la actualidad). El resultado fue la primera tabla de masas atómicas relativas (o pesos atómicos, como los llamaba Dalton), que fue posteriormente modificada y desarrollada en los años posteriores. Las inexactitudes antes mencionadas dieron lugar a toda una serie de polémicas y disparidades respecto a las fórmulas y los pesos atómicos, que solo comenzarían a superarse, aunque no totalmente, en el congreso de Karlsruhe en 1860.
Metales, no metales, metaloides y metales de transición
La primera clasificación de elementos conocida fue propuesta por Antoine Lavoisier, quien propuso que los elementos se clasificaran en metales, no metales y metaloides o metales de transición. Aunque muy práctica y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias tanto en las propiedades físicas como en las químicas.
la tabla periodica de mendeleiev
En el año 1871 Mendeleiev presentó una nueva versión de la tabla en la que mejoró la localización de algunos elementos cuya posición no era satisfactoria. Recolocó el Pb como homólogo del Sn, separándolo así del Ba (Meyer ya lo había presentado así). Cambió la posición del U que estaba en el grupo del B (con un nuevo valor del peso atómico de 240) al grupo del Cr, justo debajo del W. Cambió el peso atómico del In y lo situó en el grupo del B, como Meyer había hecho un año antes. También el Ce, La y Th fueron cambiados de lugar y pasaron al grupo del Ti y Zr gracias a un cambio en los pesos atómicos. De esta manera eliminó los ocho elementos de transición que en la propuesta anterior habían quedado por abajo y separados del resto. No obstante algunos de ellos, como Yt, Er o Di, quedaban con valores de pesos atómicos aún no muy definidos.
Al mismo tiempo hizo un cambio de filas por columnas quedando la tabla así, prácticamente igual a la que manejamos actualmente. Sólo el U fue desplazado al grupo de los actínidos por Seaborg.
La tabla había sido pesentada como una ley general para todos los elementos sin ninguna excepción. Además de dejar casillas vacías, lo cual no era ninguna novedad pues ya Odling y Meyer lo habían hecho, se atrevió a predecir las propiedades de esos elementos aun por descubrir, deducidas a partir de los valores de los cuatro elementos que los rodeaban. La exactitud de estos valores se demostró cuando fueron descubiertos y dejó a los elementos no como entes aislados e independientes sino como nudos dentro de una red interrelacionada y bien definida.
I
II
III
IV
V
VI
VII
VIII
H = 1
Li = 7
Be = 9,4
B = 11
C=12
N = 14
O = 16
F = 19
Na = 23
Mg=24
Al=27,4
Si=28
P = 31
S = 32
Cl = 35,5
K
=39
Ca=40
?=44
Ti=50?
V
=51
Cr
=52
Mn
=55
Fe=56,
Co=59, Ni=59, Cu=63
(Cu=63)
Zn=65
? =68
?=72
As =75
Se =78
Br =80
Rb=85
Sr=87
?Yt
=88?
Zr=90
Nb
=94
Mo
=96
?=100
Ru=104,
Rh=104, Pd=104, Ag =108
(Ag=108)
Cd=112
In =113
Sn=118
Sb =122
Te =128?
J =127
Cs=133
Ba=37
?
=137
Ce=138?
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Ta=182
W=184
-
Os=199,
Ir=198?, Pt=197, Au=197
(Au=197)
Hg=200
Tl=204
Pb=207
Bi=208
-
-
-
-
Th=232
-
Ur
=240
-
En el año 1871 Mendeleiev presentó una nueva versión de la tabla en la que mejoró la localización de algunos elementos cuya posición no era satisfactoria. Recolocó el Pb como homólogo del Sn, separándolo así del Ba (Meyer ya lo había presentado así). Cambió la posición del U que estaba en el grupo del B (con un nuevo valor del peso atómico de 240) al grupo del Cr, justo debajo del W. Cambió el peso atómico del In y lo situó en el grupo del B, como Meyer había hecho un año antes. También el Ce, La y Th fueron cambiados de lugar y pasaron al grupo del Ti y Zr gracias a un cambio en los pesos atómicos. De esta manera eliminó los ocho elementos de transición que en la propuesta anterior habían quedado por abajo y separados del resto. No obstante algunos de ellos, como Yt, Er o Di, quedaban con valores de pesos atómicos aún no muy definidos.
Al mismo tiempo hizo un cambio de filas por columnas quedando la tabla así, prácticamente igual a la que manejamos actualmente. Sólo el U fue desplazado al grupo de los actínidos por Seaborg.
La tabla había sido pesentada como una ley general para todos los elementos sin ninguna excepción. Además de dejar casillas vacías, lo cual no era ninguna novedad pues ya Odling y Meyer lo habían hecho, se atrevió a predecir las propiedades de esos elementos aun por descubrir, deducidas a partir de los valores de los cuatro elementos que los rodeaban. La exactitud de estos valores se demostró cuando fueron descubiertos y dejó a los elementos no como entes aislados e independientes sino como nudos dentro de una red interrelacionada y bien definida.
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
|
H = 1
|
|
|
|
|
|
|
|
|
Li = 7
|
Be = 9,4
|
B = 11
|
C=12
|
N = 14
|
O = 16
|
F = 19
|
|
|
Na = 23
|
Mg=24
|
Al=27,4
|
Si=28
|
P = 31
|
S = 32
|
Cl = 35,5
|
|
|
K
=39
|
Ca=40
|
?=44
|
Ti=50?
|
V
=51
|
Cr
=52
|
Mn
=55
|
Fe=56,
Co=59, Ni=59, Cu=63
|
|
(Cu=63)
|
Zn=65
|
? =68
|
?=72
|
As =75
|
Se =78
|
Br =80
|
|
|
Rb=85
|
Sr=87
|
?Yt
=88?
|
Zr=90
|
Nb
=94
|
Mo
=96
|
?=100
|
Ru=104,
Rh=104, Pd=104, Ag =108
|
|
(Ag=108)
|
Cd=112
|
In =113
|
Sn=118
|
Sb =122
|
Te =128?
|
J =127
|
|
|
Cs=133
|
Ba=37
|
?
=137
|
Ce=138?
|
-
|
-
|
-
|
|
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
|
-
|
-
|
-
|
-
|
Ta=182
|
W=184
|
-
|
Os=199,
Ir=198?, Pt=197, Au=197
|
|
(Au=197)
|
Hg=200
|
Tl=204
|
Pb=207
|
Bi=208
|
-
|
-
|
|
|
|
-
|
-
|
Th=232
|
-
|
Ur
=240
|
-
|
|
